1)ストレスによる脳機能低下を異性間の社会相互作用が予防する神経機構
夫婦、親子、夫婦、友人、同僚など人は様々な人間関係の中で生活していて、良好な人間関係は心身を健康に保つために重要であることはよく知られています。例えば、地元から離れた大学に入学して初めてする登校する場合を思い浮かべて下さい。初めて訪れる場所に、たった一人で行くことはとても不安だと思います。しかし、同じ高校の友人と一緒に登校する場合にはそうした不安はかなり低減すると思います。このように他の人が一緒に居ることで不安が低減したり、各種のストレスに対する応答が強化される現象を社会的緩衝作用(social
buffering)と呼びます。こうした社会的緩衝作用はマウスやラットなどの実験動物にも存在することが知られています。私たちはプレーリーハタネズミ(Microtus
ochrogaster)という動物を用いて、異性間の社会相互作用がストレスによる脳機能障害を軽減する神経機構について研究しています。
プレーリーハタネズミは、マウス位の大きさの北米原産のげっ歯類です(図1)。一度つがいを形成(pair bond)したオスとメスは生涯をパートナーとして生活する一夫一婦制を示します。また、ストレスを受けたパートナーをよく舐めて慰めるような行動を示すなど(Science
351, 375, 2016)、非常に社会性に富んだ生活様式を示します。アメリカの研究者達が中心となって、視床下部から前頭前皮質(PFC)、扁桃体、側坐核へのオキシトシンニューロンの作用や扁桃体から中隔野および腹側淡蒼球へのバソプレッシンニューロンの働き、腹側被蓋野(VTA)から前頭前皮質(PFC)や側坐核へのドパミンニューロンの作用、などがプレーリーハタネズミのpair
bondingに重要であることが明らかにされています(図1)。

図1)プレーリーハタネズミとpair bondingの神経機構右)Pair bondして巣穴でくつろぐ雌雄のプレーリーハタネズミ.左)プレーリーハタネズミのpair bondingの神経機構.扁桃体から外側中隔(LS)や腹側淡蒼球(VP)へのバソプレッシンの作用、視床下部から扁桃体、前頭前皮質(PFC)、側坐核(NAcc)へのオキシトシンの作用、及び腹側被蓋野(VTA)から側坐核と前頭前皮質へのドパミンの作用が必要とされる.ヒトでのpair bondとの共通性も認められている.
プレーリーハタネズミはげっ歯類ですから、暗い穴のような場所を好みます。この性質を利用してプレーリーハタネズミを明暗連続した箱のうち明箱入れると、すぐに暗箱に入っていくようになります。翌日、暗箱にプレーリーハタネズミが入ったら床に弱い電気を流します。するとプレーリーハタネズミは暗箱に入ると電気ショックが来ることを学習して、再度明箱に入れても暗箱に入っていかなくなります。ちなみに、こうした恐怖学習の試験を受動回避試験(passive avoidance test)と呼んで、学習・記憶などの研究に広く使用されています。ところが、数日間同じケージで雌雄の個体を飼育してpair bondさせたプレーリーハタネズミでこの試験を行うと、同性同士で飼育した個体より早く暗箱に入っていくようになり、恐怖学習が抑制されることが分かりました(図2)。重要なことはpair bondした個体は受動回避試験を行っている間は1匹で飼育されていることです。先に述べた社会的緩衝作用はストレス(この場合は暗箱で電気ショックを受けること)を受けている間に他の個体が存在することが必要とされていました。私たちは、pair bondしていれば、ストレス受容時にパートーナーが一緒に居なくてもストレスを軽減させる効果があることを見いだしました。Pair bondにオキシトシンが重要であると述べましたが、オキシトシンの阻害剤を脳内に投与しておくとpair bondによる恐怖学習の抑制効果がなくなりました。現在、脳のどの領域にオキシトシンが作用しているのかを調べているところです。こうした研究を通じて、心的外傷後ストレス障害(PTSD)などのストレス関連障害への予防法や治療法の基盤的知見を提供していきたいと考えています。

図2)Pair bondによる恐怖学習の減弱効果
左)受動回避試験の装置.白い明箱に入れられた被験動物は穴を通って奧の暗箱に入ることができる.暗箱に入ったら、右のショックスクランブラーで床から弱い電気ショックを与える.右)Pair
bondによる減弱効果.電気ショックを与える前はすぐに暗箱に入るが、電気ショックを受けた翌日はすぐに暗箱に入らない.Piar bondした個体は同性同士飼育した個体より有意に早く暗箱に入り、恐怖記憶が減弱していることが分かる.
2)遺伝子操作マウスを用いた脳内プロテアーゼによる社会行動の制御機構
1990年代に線溶系プロテアーゼの一種である組織プラスミノーゲンアクチベータ (tPA)が学習や興奮性神経細胞死に重要であることが報告されて以来、トロンビンやプラスミンといった凝固・線溶系のセリンプロテアーゼの脳内での機能について注目が集められるようになりました。我々の研究室では脳内に存在するセリンプロテアーゼを探索して、motopsin(neurotrypsin,
PRSS12とも呼ばれる)と名付けた新たなプロテアーゼを見出しました(Yamamura et al., 1997)。MotopsinはtPAのようにprotease
domainの他にsignal sequence, proline-rich domain, kringle domain, SRCR domainといった構造を持つ分泌型のマルチドメインプロテアーゼで、神経細胞から分泌されます。Motopsinの
発現はマウスでは胎生期に始まり生後2週目位までの脳の発達期に海馬や大脳皮質、脊髄運動ニューロン等で高い発現が見られますが、その後暫減しながらも生涯発現が続きます(Iijima
et al., 1999, Mitsui et al., 2007)。こうした発現動態から認知機能の獲得等への関与が示唆されていましたが、2002年にフランスのグループから重度な遺伝性知的発達障害の家系でmotopsin遺伝子の4
bpの欠損が報告されて以来(Morinari et al., 2002)、motopsinの機能不全は知的発達障害(intellectual
disability, mental retardation)の原因になると考えられています。
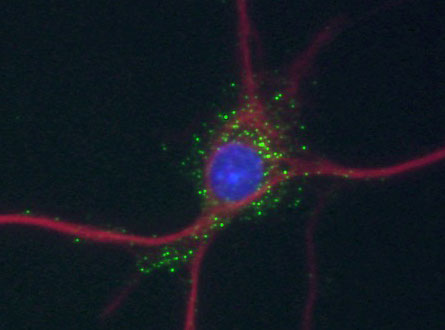
Motopsinの培養神経細胞における局在.
緑,motopsin;赤,MAP-2;青,DAPI.
我々はmotopsinの欠損が引き起こす異常の神経基盤を明らかにする目的で、motopsinを欠損するマウスの作製・解析を行いました。ヒトの場合と異なり、motopsin欠損マウスには学習障害は認められませんでしたが、他のマウスに対して野生型マウスより長い間興味を示すことが明らかになりました( 図3)。野生型マウスでは他のマウスと接触すると海馬の神経細胞が活性化されますが、motopsin欠損マウスではほとんど活性化が見られませんでした( 図4)。また、motopsin欠損マウスの海馬神経細胞の基底樹状突起ではシナプス密度が低下していることも明らかになりました(Mitsui et al., 2009)。

図3)Motopsin欠損マウスの社会行動の異常
左)Social recognition test.被験マウスに既知マウス(familiar mouse)と見知らぬマウス(unfamiliar
mouse)を10分間提示し、それぞれに対する嗅ぎ行動の時間を測定した.右)野生型マウス(WT)もmotopsin欠損マウス(KO)とも既知マウスより未知マウスに有意に長く興味(嗅ぎ行動)を示すが、motopsin欠損マウスは野生型マウスより長時間既知マウスにも興味を示した.
我々は、最近、マウス終脳の興奮性ニューロンでmotopsinを任意のタイミングで過剰発現するマウスを作製しました。驚くべきことに、このマウスの歯状回では神経新生が亢進していました(Miyata et al., 2024)。新生ニューロンの活性化は大うつ病の症状を緩和することが動物モデルを用いて報告されており(Tunc-Ozcan et al., 2019, Sun et al., 2020)、motopsin過剰発現マウスでの神経新生の亢進が精神疾患に及ぼす影響なども検討していく予定です。
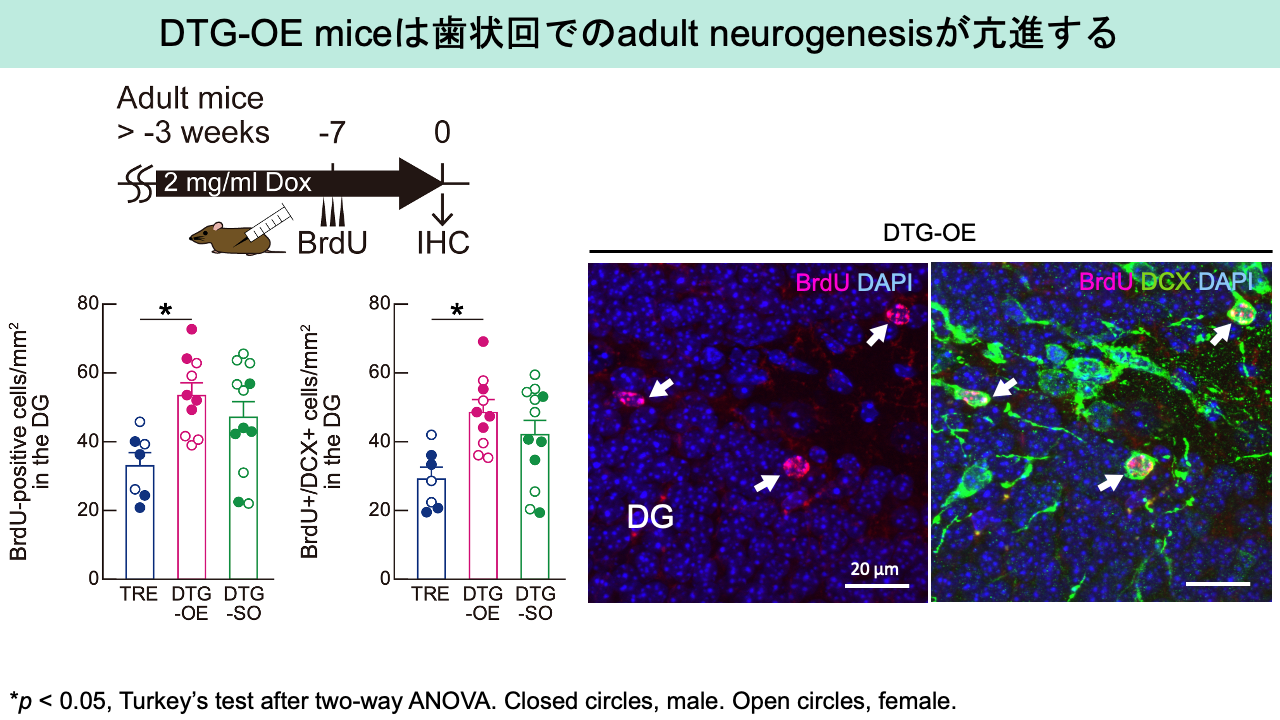
図4)Motopsin過剰発現マウス海馬歯状回での神経新生の亢進
左上)実験スケジュール.対照群にはmotopsinの過剰発現を抑制するためにドキシサイクリン(Dox)を投与した.細胞増殖の指標となるBrdUを腹腔内投与した7日後に海馬歯状回での神経細胞の増殖を確認した下左)海馬歯状回でのBrdU取り込み細胞数およびBrdUとdouble
cortin (DCX)とのに重要性細胞数.DTG-OEがmotopsin過剰発現マウス,TREとDTG-SOはmotopsinの発現量は通常の対照群」右)DTG-OEマウスでのBrdU取り込み細胞とDCXとの免疫染色像.